Reakcje chemiczne zachodzące na odsłoniętym podłożu metalowym
Podczas etapu suszenia powłoki grubość warstwy elektrolitu maleje. Z powodu zmniejszenia grubości elektrolitu prąd redukcyjny jest również zmniejszony. Na etapie suszenia nie ma już dyfuzji tlenu, a występuje tylko prąd redukcyjny. Suszenie powoduje zmniejszenie powierzchni anodowej i katodowej, co ostatecznie zatrzyma reakcje elektrochemiczne z powodu niedoboru elektrolitu.
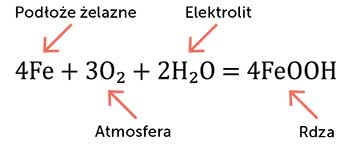
Korozja chemiczna
Korozja chemiczna polega na bezpośredniej reakcji metalu z czynnikiem wywołującym korozję. Czynnikiem tym może być na przykład tlen z powietrza. Typowym przykładem jest utlenianie żelaza do jego tlenków w wysokiej temperaturze. Do tej samej grupy procesów należy również czernienie przedmiotów srebrnych na powietrzu (pokrywanie się nalotem, którego głównym składnikiem jest siarczek srebra). Korozja chemiczna atakuje najczęściej całą powierzchnię stykającą się z czynnikiem wywołującym korozję. Nie stanowi ona na ogół dużego zagrożenia dla konstrukcji i przedmiotów metalowych w niezbyt wysokich temperaturach.
Zjawisko tworzenia takiej warstwy nosi nazwę pasywacji. Jest ona przyczyną dość wysokiej odporności glinu na korozję, mimo że jest on metalem o dużej reaktywności. Taką ochronną warstwę można wytworzyć nie tylko na powierzchni glinu, ale również innych metali, także stali. Proces ten nosi nazwę oksydacji i jest jedną z metod ochrony antykorozyjnej.
Możliwym mechanizmem zmniejszenia prądu redukcyjnego może być zjawisko pasywacji. Zarówno spadek grubości warstwy elektrolitu, jak i wzrost stężenia podczas pierwszego etapu cyklu mokro–suchego skutkuje pokryciem powierzchni metalu warstwą pasywną. To z czasem zmniejsza zarówno obszary katodowe, jak i anodowe, a zatem pokrycie niewielkiego obszaru anodowego zapobiega dalszemu powstawaniu żelaza rozpuszczonego. Blokowanie miejsc anodowych i dyfuzja rozpuszczonych soli pasywnych ograniczają prąd utleniania. Występuje proces blokowania anody zgodnie z następującym równaniem:
Fe → Fe+2 + 2e–
Fe+2 + 2OH– → Fe(OH)₂ ↓
Pod koniec etapu suszenia warstwa rdzy jest spolaryzowana z uwagi na większy potencjał dodatni do rosnącego prądu katodowego, co z kolei powoduje regenerację γ-FeOOH z γ-Fe.OH.OH. Pozwoli to na pojawienie się kolejnego cyklu, gdy pojawi się rdza ponownie zmoczona.
Utlenianie metalu do jego tlenków nie zawsze jest procesem szkodliwym. Jeżeli warstwa tlenku jest dostatecznie zwarta i mocno związana z powierzchnią metalu, chroni ona metal przed dalszym utlenianiem.
Rdzewienie w wilgotnym cyklu:
anoda: Fe → Fe+2 + 2e–
i Fe+2 → Fe+3 + e–
katoda:
O₂ + 4e– + 2H₂O → 4OH–
Łączna reakcja z udziałem jonów chlorkowych:
Fe+2/ Fe+3 + Cl– + OH–
→ FeOCl + HCl
W suchym cyklu:
FeOCl → β FeOOH (rdza trygonalny Akagaeinit).








